能量变化两种图像的考查
化学反应的能量变化取决于反应物和生成物具有的总能量的相对大小,取决于发生反应破坏旧的化学键吸收的能量与形成新的化学键放出能量的相对大小。这是理解化学反应热效应的两种角度,如放热反应可以分别表示为图中两种图像: 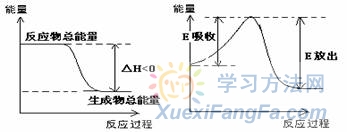 08的两道高考题正是通过这两种图像形式对能量变化知识点进行了考查。 (08全国II·26).红磷 P (s)和 Cl2(g)发生反应生成 PCl3(g)和 PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成 l mol 产物的数据)。根据上图回答下列问题:
08的两道高考题正是通过这两种图像形式对能量变化知识点进行了考查。 (08全国II·26).红磷 P (s)和 Cl2(g)发生反应生成 PCl3(g)和 PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成 l mol 产物的数据)。根据上图回答下列问题: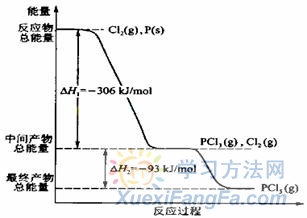 ( l ) P 和 CI2反应生成 PC13 的热化学方程式是_________________( 2 ) PC15 分解成 PC13 和 Cl2的热化学方程式是_________________上述分解反应是一个可逆反应。温度 Tl 时,在密闭容器中加人 0.80 mol PC15 ,反应达平衡时 PC15 还剩 0.60 mol ,其分解率 al 等于_________;若反应温度由 Tl 升高到T2,平衡时 PC15 的分解率为a2,a2______ al (填“大于”、“小于”或“等于”)( 3 )工业上制备 PC15 通常分两步进行,先将 P 和 C12 反应生成中间产物 PC13 ,然后降温,再和 Cl2 反应生成 PCl5 。原因是________________________________________( 4 ) P 和 C12 分两步反应生成 1 mol PC15 的△H3==__________,一步反应生成 1 mol PC15 的△H4____△H3(填“大于”、“小于”或“等于”)。(5)PC15 与足量水充分反应,最终生成两种酸,其化学方程式是 :___________________。 【解析】此“瀑布式”能量图说明红磷和氯|气反应为分步的放热反应,相反PC15 分解成 PC13 和 Cl2是吸热反应即:PCl5(g)
( l ) P 和 CI2反应生成 PC13 的热化学方程式是_________________( 2 ) PC15 分解成 PC13 和 Cl2的热化学方程式是_________________上述分解反应是一个可逆反应。温度 Tl 时,在密闭容器中加人 0.80 mol PC15 ,反应达平衡时 PC15 还剩 0.60 mol ,其分解率 al 等于_________;若反应温度由 Tl 升高到T2,平衡时 PC15 的分解率为a2,a2______ al (填“大于”、“小于”或“等于”)( 3 )工业上制备 PC15 通常分两步进行,先将 P 和 C12 反应生成中间产物 PC13 ,然后降温,再和 Cl2 反应生成 PCl5 。原因是________________________________________( 4 ) P 和 C12 分两步反应生成 1 mol PC15 的△H3==__________,一步反应生成 1 mol PC15 的△H4____△H3(填“大于”、“小于”或“等于”)。(5)PC15 与足量水充分反应,最终生成两种酸,其化学方程式是 :___________________。 【解析】此“瀑布式”能量图说明红磷和氯|气反应为分步的放热反应,相反PC15 分解成 PC13 和 Cl2是吸热反应即:PCl5(g) ![]() PCl3(g) + Cl2(g);△H= +93 kJ/mol,反应的PCl5是0.80-0.60=0.20 mol,转化率为25%,升高温度平衡正向移动,PC15 的分解率增大。工业上制备 PC15两步反应都是放热反应,第二步反应还为可逆反应,温度太高不利于生成PCl5,所以分两步中间降温有利于提高产率,防止产物分解。根据盖斯定律,反应产生的能量与途径无关,所以分一步分两步产生热量相等,△H3=△H1+△H2=-399 kJ/mol=△H4。PCl5水解得到两种酸,根据化合价判断为磷酸和盐酸。 【答案】(1)2P(s) + 3Cl2(g)==2PCl3(g);△H =-612 kJ/mol (2)PCl5(g)
PCl3(g) + Cl2(g);△H= +93 kJ/mol,反应的PCl5是0.80-0.60=0.20 mol,转化率为25%,升高温度平衡正向移动,PC15 的分解率增大。工业上制备 PC15两步反应都是放热反应,第二步反应还为可逆反应,温度太高不利于生成PCl5,所以分两步中间降温有利于提高产率,防止产物分解。根据盖斯定律,反应产生的能量与途径无关,所以分一步分两步产生热量相等,△H3=△H1+△H2=-399 kJ/mol=△H4。PCl5水解得到两种酸,根据化合价判断为磷酸和盐酸。 【答案】(1)2P(s) + 3Cl2(g)==2PCl3(g);△H =-612 kJ/mol (2)PCl5(g) ![]() PCl3(g) + Cl2(g);△H= +93 kJ/mol 25% 大于 (3) 两步反应都是放热反应,降温有利于提高产率,防止产物分解 (4) -399 kJ/mol 等于 (5)PCl5 + 4H2O==H3PO4 + 5HCl (08重庆理综·13)化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是( )。
PCl3(g) + Cl2(g);△H= +93 kJ/mol 25% 大于 (3) 两步反应都是放热反应,降温有利于提高产率,防止产物分解 (4) -399 kJ/mol 等于 (5)PCl5 + 4H2O==H3PO4 + 5HCl (08重庆理综·13)化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是( )。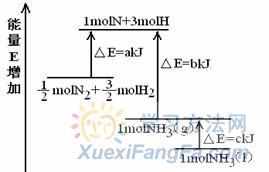 A.N2(g)+3H2(g)=2NH3(1);△H=2(a-b-c)kJ·mol-1B. N2(g)+3H2(g)=2NH3(g); △H=2(b-a) kJ·mol-1C.
A.N2(g)+3H2(g)=2NH3(1);△H=2(a-b-c)kJ·mol-1B. N2(g)+3H2(g)=2NH3(g); △H=2(b-a) kJ·mol-1C.![]() N2(g)+
N2(g)+![]() H2(g)=NH3(1); △H=(h+c-a) kJ·mol-1D.
H2(g)=NH3(1); △H=(h+c-a) kJ·mol-1D. ![]() N2(g)+
N2(g)+![]() H2(g)=NH3(g); △H=(a+b) kJ·mol-1 【解析】理解a、b、c的含义以及符号。a为氮气和氢气分解为氮原子和氢原子吸收的能量,b为氨分子分解为氮原子和氢原子吸收的热量,c为液态氨转化为气态氨吸收的热量。氮气氢气合成氨气的反应热包括氮气氢气分解为氮原子吸收的热量与氮原子氢原子合成氨气放出热量的相对大小,如果生成气态氨,△H=-2(b-a)kJ/mol=2(a-b)kJ/mol,如果生成液态氨△H=-2(b+c-a)kJ/mol=2(a-b-c)kJ/mol。选A。 【点评】两种图像,两种视角,形式有别,实质相同。能量变化是化学变化的另一条线索,关注其考查方式,才能更好的理解并灵活运用能量图像解题,突破难点,形成思路方法。
H2(g)=NH3(g); △H=(a+b) kJ·mol-1 【解析】理解a、b、c的含义以及符号。a为氮气和氢气分解为氮原子和氢原子吸收的能量,b为氨分子分解为氮原子和氢原子吸收的热量,c为液态氨转化为气态氨吸收的热量。氮气氢气合成氨气的反应热包括氮气氢气分解为氮原子吸收的热量与氮原子氢原子合成氨气放出热量的相对大小,如果生成气态氨,△H=-2(b-a)kJ/mol=2(a-b)kJ/mol,如果生成液态氨△H=-2(b+c-a)kJ/mol=2(a-b-c)kJ/mol。选A。 【点评】两种图像,两种视角,形式有别,实质相同。能量变化是化学变化的另一条线索,关注其考查方式,才能更好的理解并灵活运用能量图像解题,突破难点,形成思路方法。