用“一分为二”的“模型”解溶液计算题
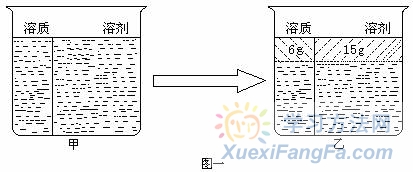
有关溶液的计算是高中化学的一个重点知识,然而由于其计算较为抽象,学生不容易找到其中的量的关系,如果把溶液“一分为二”看待,并建立相应的“模型” ,则会使问题简单化,所谓“一分为二”是指把溶液中的溶质和溶剂“分割”开来,即把溶质、溶剂 “看成”是溶液中两个“独立”的部分去分析溶液并解决相关问题,则学生很容易理解和掌握。如下图所示,如果是饱和溶液,就可看做像影剧院中对号入座一样,溶质、溶剂是一一对应的关系,但要注意不是相等关系。如果是不饱和溶液,则可以看作溶剂“多”出一部分来建立“模型”。 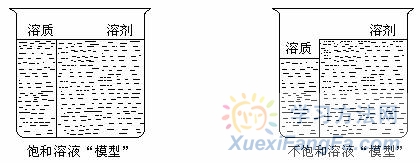 例1.20 ℃时,将硝酸钾的饱和溶液蒸发15g水后析出6g晶体,求此温度下硝酸钠的溶解度为多少? 解析:因为该题明确告诉是饱和溶液则,先“建立”图一甲所示“模型”,然后画出图一乙所示“模型”,即6 g溶质和15 g溶剂刚好形成饱和溶液则:
例1.20 ℃时,将硝酸钾的饱和溶液蒸发15g水后析出6g晶体,求此温度下硝酸钠的溶解度为多少? 解析:因为该题明确告诉是饱和溶液则,先“建立”图一甲所示“模型”,然后画出图一乙所示“模型”,即6 g溶质和15 g溶剂刚好形成饱和溶液则:![]()
 例2.氯化钠在10 ℃时的溶解度是30g,现有20%的氯化钠溶液250g,若要使它在该温度下析出2g氯化钠晶体,需要蒸发掉水的质量是多少克? 解析:题目告诉的溶解度是30g,质量分数20%,显然该溶液不饱和,所以先“建立” 图二甲所示“模型”,然后画出乙图所示“模型”,即去掉ag溶剂后形成 饱和溶液,设饱和后再减少b g溶剂刚好析出2g溶质,则有下式:
例2.氯化钠在10 ℃时的溶解度是30g,现有20%的氯化钠溶液250g,若要使它在该温度下析出2g氯化钠晶体,需要蒸发掉水的质量是多少克? 解析:题目告诉的溶解度是30g,质量分数20%,显然该溶液不饱和,所以先“建立” 图二甲所示“模型”,然后画出乙图所示“模型”,即去掉ag溶剂后形成 饱和溶液,设饱和后再减少b g溶剂刚好析出2g溶质,则有下式:![]() 所以设共需蒸发水的质量为:a+b=33.3g+6.7g=40g
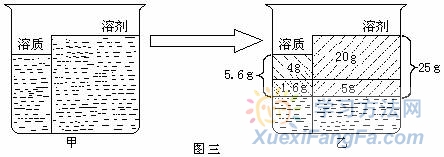
所以设共需蒸发水的质量为:a+b=33.3g+6.7g=40g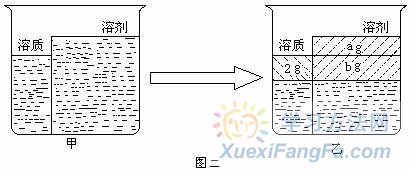 例3.15 ℃时,将200g硝酸钾溶液蒸发掉20g水后,析出4g晶体;相同温度下,蒸发掉25g水后,析出5.6g晶体。则15 ℃时,KNO3的溶解度是多少克? 解析:由题意可知该溶液是不饱和溶液,所以先“建立”图三甲所示“模型”, 然后画出图三乙图所示“模型”.所以有下式:
例3.15 ℃时,将200g硝酸钾溶液蒸发掉20g水后,析出4g晶体;相同温度下,蒸发掉25g水后,析出5.6g晶体。则15 ℃时,KNO3的溶解度是多少克? 解析:由题意可知该溶液是不饱和溶液,所以先“建立”图三甲所示“模型”, 然后画出图三乙图所示“模型”.所以有下式: ![]()
 例4.有一固体物质(不含结晶水)的溶液甲,在一定温度下,经历如下变化:
例4.有一固体物质(不含结晶水)的溶液甲,在一定温度下,经历如下变化:
溶液甲→蒸发10g水无晶体析出→溶液乙→蒸发10g水析出3g晶体→溶液丙
据此推断,下列结论正确的是( )
A.该温度下,固体物质的溶解度是30g
B.溶液丙若再蒸发10g水,析出晶体的质量一定大于3g
C.溶液乙一定是不饱和溶液 D.溶液乙和溶液丙中的溶质质量分数可能相等 解析:由题意可知该溶液是不饱和溶液,所以先“建立” 不饱和溶液的“模型”, 然后画出图四所示“模型”. 由于溶液甲→蒸发10g水无晶体析出后所得溶液乙有两种情况:饱和(如图甲)和不饱和(如图乙),溶液乙→蒸发10g水析出3g晶体所得溶液丙一定是饱和溶液,A选项.该温度下溶解度:若是图甲则![]() 若是图乙则S>30g,B选项.若是图甲溶液丙若再蒸发10g水,析出晶体的质量等于3g,若是图乙溶液丙若再蒸发10g水,析出晶体的质量一定大于3g,C选项.从图中可以直观地看出来,D选项.若是图甲,溶液丙和溶液乙是同温度下的饱和溶液故相等,若是图乙,溶液丙是饱和溶液,溶液乙是不饱和溶液故不相等。所以选D。
若是图乙则S>30g,B选项.若是图甲溶液丙若再蒸发10g水,析出晶体的质量等于3g,若是图乙溶液丙若再蒸发10g水,析出晶体的质量一定大于3g,C选项.从图中可以直观地看出来,D选项.若是图甲,溶液丙和溶液乙是同温度下的饱和溶液故相等,若是图乙,溶液丙是饱和溶液,溶液乙是不饱和溶液故不相等。所以选D。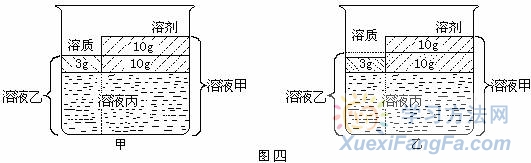 综上所述,用该方法解溶液题时,先看溶液是否饱和,然后 “建立”相对应的“模型”,再根据题意在“模型”上画出符合该题意的衍生“模型”,进而求解。 练习 1.室温下140 g某溶液,第一次蒸发10 g水时,溶液中析出2 g溶质,再继续蒸发20 g水时,溶液中又析出5g溶质。则原溶液至少需蒸发多少克水可变为饱和溶液( )。A.2 g B.8 g C.10 g D.20 g 2.20 ℃时,把一定质量的硝酸钾溶液分成两等份,一份恒温蒸发掉10 g水析出1 g硝酸钾晶体,另一份恒温蒸发掉15 g水,析出2 g硝酸钾晶体。下列说法错误的是( )。A.20 ℃时,若将原溶液恒温蒸发掉25 g水,可析出3 g硝酸钾晶体B.20 ℃时,若原溶液中再加入2 g硝酸钾晶体便成为饱和溶液C.20 ℃时,硝酸钾的溶解度为20 gD.20 ℃时,原硝酸钾溶液的质量分数为12% 3.10 ℃时,某物质不饱和溶液a g中含有m g溶质,若该溶液蒸发b g水并恢复到10℃时,析出溶质m1 g;若原溶液蒸发c g水并恢复到10 ℃,析出溶质m2 g,则该物质在10 ℃的溶解度的表达式为 参考答案:1. A 2. D 3. S=100(m1-m2)/(b-c)(或S=100(m2- m1)/(c-b))
综上所述,用该方法解溶液题时,先看溶液是否饱和,然后 “建立”相对应的“模型”,再根据题意在“模型”上画出符合该题意的衍生“模型”,进而求解。 练习 1.室温下140 g某溶液,第一次蒸发10 g水时,溶液中析出2 g溶质,再继续蒸发20 g水时,溶液中又析出5g溶质。则原溶液至少需蒸发多少克水可变为饱和溶液( )。A.2 g B.8 g C.10 g D.20 g 2.20 ℃时,把一定质量的硝酸钾溶液分成两等份,一份恒温蒸发掉10 g水析出1 g硝酸钾晶体,另一份恒温蒸发掉15 g水,析出2 g硝酸钾晶体。下列说法错误的是( )。A.20 ℃时,若将原溶液恒温蒸发掉25 g水,可析出3 g硝酸钾晶体B.20 ℃时,若原溶液中再加入2 g硝酸钾晶体便成为饱和溶液C.20 ℃时,硝酸钾的溶解度为20 gD.20 ℃时,原硝酸钾溶液的质量分数为12% 3.10 ℃时,某物质不饱和溶液a g中含有m g溶质,若该溶液蒸发b g水并恢复到10℃时,析出溶质m1 g;若原溶液蒸发c g水并恢复到10 ℃,析出溶质m2 g,则该物质在10 ℃的溶解度的表达式为 参考答案:1. A 2. D 3. S=100(m1-m2)/(b-c)(或S=100(m2- m1)/(c-b))